Le système de surveillance des voies respiratoires SonarMed rappelé en raison d’un problème logiciel
La FDA a identifié cela comme un rappel de classe I, le type de rappel le plus grave. L’utilisation de ces appareils peut provoquer des blessures graves, voire la mort.
Produit rappelé
- Noms du produit : Moniteurs SonarMed Airway
- Codes produits : OQU
- Numéros de modèle: AW-M0001
- Dates de distribution : du 13 octobre 2022 au 6 octobre 2023
- Appareils rappelés aux États-Unis : 145
- Date de lancement par l’entreprise : 25 mars 2024
Utilisation de l’appareil
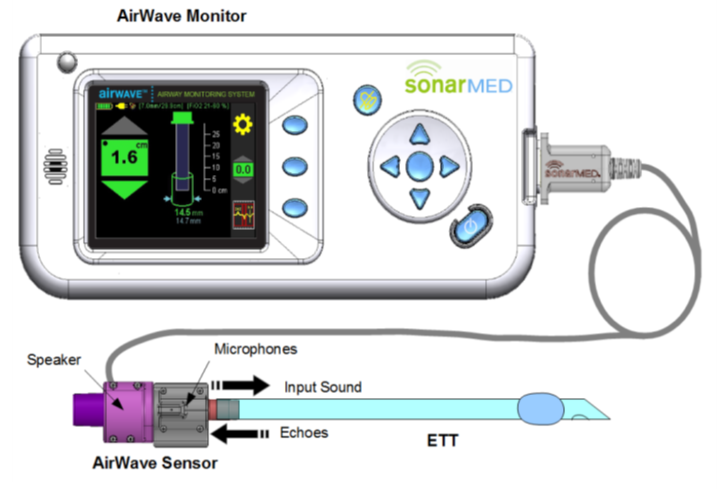
Le système de surveillance des voies respiratoires SonarMed (AMS) comprend un moniteur SonarMed (moniteur) utilisé conjointement avec un capteur SonarMed (capteur) à usage unique pour un patient, connecté via une connexion par câble externe, et un logiciel qui fait fonctionner le moniteur et le capteur.
Lorsqu’il est utilisé, le capteur des voies respiratoires SonarMed AirWave est placé en ligne entre le circuit du ventilateur et l’extrémité proximale de la sonde endotrachéale (ETT) d’un patient connecté à un ventilateur. Le capteur remplace le connecteur standard de 15 mm (également appelé hub) fourni avec l’ETT et utilise la technologie de réflexion acoustique pour fournir des informations en temps réel aux cliniciens. Cela inclut l’emplacement de base de la pointe ETT, l’estimation de la taille du passage autour de la pointe, la détection du mouvement ETT et l’identification des occlusions ou des obstructions.
Le système de surveillance des voies respiratoires SonarMed est destiné à être utilisé par des professionnels de la santé qualifiés pour soutenir la gestion des voies respiratoires artificielles en milieu hospitalier tel que les unités de soins intensifs, les salles d’opération, les services d’urgence et pendant le transport intra-hospitalier. Il est destiné à compléter les pratiques cliniques standard et n’est pas destiné à être un outil de diagnostic autonome. Le système peut être utilisé sur un large éventail de patients, notamment les nouveau-nés, les nourrissons, les enfants, les adolescents et les adultes, couvrant une plage de tailles allant de 2,5 mm à 9,0 mm pour les sondes endotrachéales.
Raison du rappel
SonarMed Inc. rappelle le système de surveillance des voies respiratoires SonarMed en raison d’un problème logiciel entraînant l’incapacité de détecter une obstruction partielle dans les capteurs de 2,5 mm et s’étendant jusqu’à 3 mm en aval de l’extrémité du capteur.
L’utilisation de la seringue concernée peut avoir de graves conséquences sur la santé, notamment des retards de traitement, une insertion accidentelle dans les bronches, des niveaux d’oxygène plus faibles (hypoxie), une fuite d’air dans la cavité thoracique (pneumothorax), une quantité d’air insuffisante atteignant les poumons (hypoventilation). ), des atteintes aux tissus, un ralentissement du rythme cardiaque (bradycardie), voire des problèmes respiratoires entraînant une insuffisance respiratoire.
Aucun blessé ni décès n’a été signalé.
Qui peut être concerné
- Les prestataires de soins de santé qui utilisent le système de surveillance des voies respiratoires SonarMed pour soutenir la gestion des voies respiratoires artificielles.
- Les personnes qui reçoivent des soins avec le système de surveillance des voies respiratoires SonarMed sont destinées à être utilisées par des professionnels de la santé qualifiés pour soutenir la gestion des voies respiratoires artificielles.
Ce qu’il faut faire
Le 25 mars 2024, Medtronic, au nom de SonarMed Inc., a envoyé à tous les clients concernés un avis de rappel urgent de dispositif médical.
La lettre demandait aux clients de :
- Cesser d’utiliser les moniteurs concernés et mettre en quarantaine tous les produits SonarMed Airway System.
- Renvoyez tous les moniteurs des voies respiratoires SonarMed mis en quarantaine à Medtronic.
- Remplissez et renvoyez le formulaire de confirmation client inclus à rs.gmbmitgfca@medtronic.com.
- Partagez ces informations partout où les moniteurs SonarMed Airway peuvent avoir été transférés ou distribués.
Coordonnées
Les clients aux États-Unis ayant des questions concernant ce rappel doivent contacter le représentant Medtronic ou le service client au 800-962-9888, option 2.
Ressources additionnelles:
Comment signaler un problème ?
Les professionnels de la santé et les consommateurs peuvent signaler les effets indésirables ou les problèmes de qualité qu’ils ont rencontrés en utilisant ces appareils à MedWatch : The FDA Safety Information and Adverse Event Reporting Program en utilisant un formulaire en ligne, un courrier ordinaire ou un FAX.